研究紹介(ニッケル系)
ニッケル系 | フッ素系
はじめに
ニッケルはクラーク数(地殻中に存在する元素の存在比)の大きな埋蔵量の多い遷移金属であり、 触媒としての利用に期待が持たれています。しかし、現状では十分にそのポテンシャルを引き出して利用しているとは言い難い。 そこで、生越研究室ではニッケルの原子半径が遷移金属の中で最も小さい点に着目し、 大きな配位子の導入により反応場を制御して不活性結合の活性化や酸化的環化による環状ニッケル化合物の効率的な発生を実現し触媒反応へと展開してきました。
反応場の制御 ~小さな金属と大きな配位子の組合せ~
小さな遷移金属の配位圏に大きな配位子を導入すると、必然的に他分子が配位できる空間は小さくなります。 このため配位している分子の自由な動きは大きく制限され、その結果、2つの反応基質は互いに近づくこととなります(Scheme 1 において基質A、基質Bの距離が近くなる)。 また、原子半径が小さいため金属中心と配位子との結合距離も短くなり、互いの相互作用(電子の授受)が大きくなります。
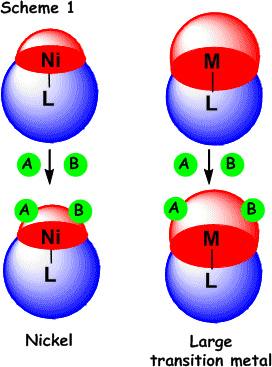
ニッケルは遷移金属においてイオン半径、金属結合半径ともに最も小さい上に還元力が非常に強い。 そのため、他の遷移金属にはない『電子リッチで非常に小さな配位圏』を持っています。このことを『大きな配位子を有する 0価ニッケルの特徴的な反応性』として言い換えると、 次の二点に集約されます:
1) 反応基質とニッケルの距離が近いため不活性結合ですら簡単に切断される可能性が高くなる。
2) 二つの異なる不飽和結合とニッケルとの酸化的環化が起こりやすくなる。
不活性結合の活性化
不活性結合を活性化する手法は多岐に渡り、実際に多様な触媒反応に展開されています。特に、炭素-水素 (C-H) 結合、 炭素-炭素 (C-C) 結合、炭素-フッ素 (C-F) 結合は不活性結合(結合エネルギーが大きく切断されにくい)として知られており、 世界中の研究者がこれらの結合の活性化実現に向けて精力的に研究しています。しかし、殆どの研究者のアプローチが似通っているため、 同じような化合物群に対しての研究に限られているのが現状であります。
生越研究室では反応場制御を鍵として不活性結合として知られている3種類の結合、炭素-水素結合、 炭素-炭素結合、炭素-フッ素結合の解裂(活性化)に成功しています。また、いずれのプロセスも、 新たな触媒反応へと展開してきました。
炭素-水素結合活性化
単純アルケンのエノンへの直接共役付加反応
α,β-不飽和化合物のβ位に種々のアルケニル基を導入するには、アルケニル金属化合物を共役付加させる反応が古くから利用されてきました。 しかし、反応終了後には使用した金属を塩として除去する必要があります。さらに、使用するアルケニル金属化合物の調製にハロゲン化アルケンが必要であり、 このハロゲン化アルケンの調製にアルケンからのハロゲン化反応が必要である。同時に、ハロゲン化試薬、 金属化試薬なども必要となるため反応全体を通して廃棄される反応副生物の量は極めて多くなるとともに、 目的化合物を入手するまでに多段階が必要となります。
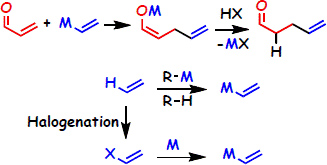
一方、我々が見出した反応では、アルケンを直接共役付加させるため目的物を入手するための行程が短段階であるために、 反応の準備のためのプロセスが不要となり廃棄物が極小になると同時に必要なエネルギーも極小となります。そのため、省資源、 省エネルギーに大きく貢献できる。ルテニウムを触媒としてもエノンと単純アルケンとの反応からβ位に炭素-炭素結合を生成させることも可能ですが、 この場合は、エノンから置換数の増えたエノンが生成するため共役付加とはなっていない。 本反応は、2009年の触媒討論会において1000件以上の発表から注目発表に選定されました。
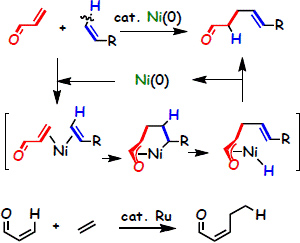
エチレンを用いた場合には、選択的に2分子のエチレンを連続的に取り込んだ化合物も得られます。 用いる配位子を変えると、1分子のみを取り込んだ化合物も選択的に得られます。 本反応は異性化を初めて抑制して末端にビニル基を保持した生成物を与える初めての反応です。従来法のヒドロビニル化では、 必ずビニル基は内部に異性化してしまいますが、本反応は1段階で末端にビニル基を導入する反応として極めて優れた可能性を秘めています。
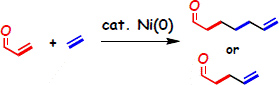
ティッシェンコ反応
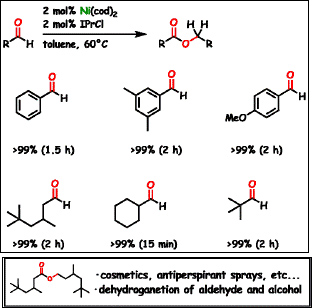
アルデヒドの二量化によるエステル合成(ティッシェンコ反応)は、廃棄物のでない理想的な反応であり、 工業的規模での実用化もされている反応です。それゆえに、多様な触媒が開発されてきました。しかし、 アリール(芳香族)アルデヒド、アリファティック(脂肪族)アルデヒドの両方に適用できる触媒は非常に限られており、 その上、エノール化しやすいアルデヒドに適用できる触媒は殆どありませんでした。
我々のグループでは、ニッケル上に大きな配位子を導入することで酸化的環化を促進させニッケルを触媒とする初めてのティッチェンコ反応を構築しました。 本反応を用いることにより、制汗剤として実際に利用されているエステルを従来法よりも効率よく、そして純度の高いものとして得ることができます。
炭素-炭素結合活性化
シクロプロピルケトンの炭素-炭素結合解裂:選択的 [3 + 2] 環化付加反応
ニッケル上に大きな配位子を導入して反応場を制御することにより、これまで達成されていなかった穏和な条件でのシクロプロピルケトン類の C-C 結合活性化と共役エノンとの [3 + 2] 環化付加を実現しました。このような反応場制御はC-C結合の切断のみならず、 反応中間体の構造にも影響を及ぼしていることが判明しています。すなわち、低温にて単離した中間体は T 字型 14 電子錯体という高活性状態であり、反応場制御なしには触媒反応への応用は困難であったと考えています。
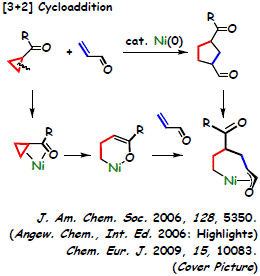
この錯体の持つ重要な意味は投稿した学術雑誌においても高く評価され、掲載誌の表紙絵 (Cover Picture) として選定されました。同時に、この成果は、2008年の触媒討論会において千件を超える発表の中から注目発表に選定された。また、ミシガン州立大学のモンゴメリ教授の論文との連報として発表した触媒反応は、WILEY 社の Angewandte Chemie International Edition のハイライトに新しい反応として紹介された。
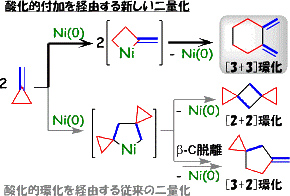
メチレンシクロプロパン類の炭素-炭素結合開裂:選択的 [3 + 3] 環化二量化反応
ニッケル(0)触媒存在下、置換メチレンシクロプロパン類の炭素-炭素結合の活性化が起こり、 反応基質の二量化体である六員環エキソジエンを与える [3 + 3] 環化二量化反応を見いだしました。 本触媒反応を注意深く追跡したところ、生成物の六員環ジエンがニッケルに配位した錯体の捕捉に成功しました。
![メチレンシクロプロパン類の炭素-炭素結合開裂:選択的 [3 + 3] 環化二量化反応](../src/img/research/nickel_img7.jpg)
メチレンシクロプロパンの環化二量化はNi(0)触媒によって進行し、4員環や5員環生成物を与えることが知られていましたが、 その機構はNi上での酸化的環化を経由する可能性が高いと推定されてきました。我々は前述のシクロプロピルケトンに関する知見から、 ニッケル上にかさ高く、そして電子リッチな配位子を導入した反応場を用いることにより、 シクロプロパン環の炭素-炭素結合の開裂を伴った新たな反応の開発を達成することができました。
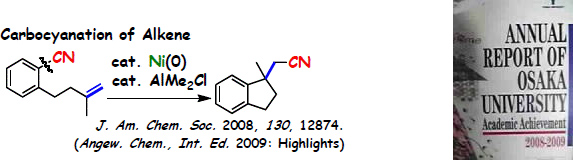
アルケンの分子内カルボシアノ化反応
ニッケルと有機アルミニウムの協奏効果により進行するアリールシアノ化反応を開発し、その反応機構を解明しました。 この反応では、酸化的付加による芳香族ニトリルの C-C (Ar-CN) 結合の活性化に有機アルミニウムが必要でしたが、 この場合にも大きな配位子を導入して反応場制御を行うと有機アルミニウムを必要とすることなく C-C 結合活性化を鍵とする触媒反応が進行しました。
本研究は、 京都大学檜山研究室との共同研究の成果である。
なお、この論文も WILEY 社の Angewandte Chemie International Edition のハイライトに新しい反応として紹介されています。
さらに、大阪大学年報においてもグラフィック24選に選出されるなど高い評価を受けています。