
Research
上図の項目をクリックすると各項目の先頭にジャンプします。
いまだかつてない化学反応・分子の発見を目指して
医薬品、プラスチック、液晶など、われわれの身の回りには、有機化合物があふれています。これらの有機化合物が望む機能を発現しているのは、それらの分子構造と密接な関係があります。したがって、望む機能を持つ分子を生み出すためには、その構造を構築するための手段、すなわち化学反応の開発が不可欠です。有機化学の教科書を眺めれば、Aldol縮合やDiels-Alder反応など、既にたくさんの化学反応が記載されています。果たして、これ以上新しい反応を開発する必要はあるのでしょうか?答えは、Yesです。新反応の開発は、既存の物質製造プロセスを低環境負荷、高効率省資源型へと革新するだけではなく、既存の手法では作り得なかった新分子の創成へと結実することもあるからです。例えば、21世紀のノーベル化学賞の多くが、不斉水素化及び酸化、メタセシス、クロスカップリングといった新しく開発された反応に対して与えられています。これらの反応の発見により、それまで存在しなかったキラル化合物、ポリマーあるいはπ共役化合物の化学合成が可能となり、社会に大きなインパクトを与えたのです。われわれの研究室では、そのような新しい化学反応を開発することを目指しています。われわれの研究には「こだわり」があります。それは、改良・改善ではなく未知にチャレンジするということです。既存の反応の収率を10%から90%に向上させる研究も重要ですが、われわれの研究対象ではありません。追い求めるのは、誰も見たことのないパターンの化学反応です。「なぜ、この原料からこの分子が生成するの?」といった反応機構が容易にはわからないような反応(すなわち、既存の反応原理では説明がつかないような反応)が、われわれの理想とする反応です。このような、いまだかつてない反応の発見は、もしかすると現代社会を一変させるようなインパクトを持つかもしれないのです。そんな想像が、このイバラの道を進むためのモチベーションを与えてくれます。
化学反応をデザインする
われわれの研究室では、新しい反応を開発するためのツールとして、主として遷移金属錯体触媒を活用しています。錯体触媒の出現は、クロスカップリングやメタセシスに代表されるように古典的な有機合成化学を一変させてきました。しかし、遷移金属の種類やそれを取り囲む配位子の多様性を考慮すると、これまでに明らかになった錯体触媒の反応性は、ほんの氷山の一角にすぎないといえます。残念ながら、未知の反応を完全にデザインし、発見を予見できるほど、この分野の化学は成熟していません。しかし、逆にそれゆえ、われわれ化学者が創造力(あるいは想像力?)を発揮する余地が大きい分野であるといえます。敢えて、やや大胆とも言える仮説を立て、触媒、配位子、基質分子の構造をデザインします。デザインするのは分子だけではありません。触媒反応は、触媒サイクルという素反応の組み合わせにより成り立っており、それらの素反応を組み合わせて、触媒反応をデザインします。素反応そのものを新しくデザインすることもあります。多くの場合、デザイン通り事がうまく運ぶことはありません。しかし、何度も修正を繰り返しながら、よりよいデザインを突き詰めていったり、あるいは当初予想もしていなかったような現象に遭遇して、全く新しいデザインを着想したりすることで、この海図なき航海はゴールへと行き着くのです。独創性の高いアイディアをいかに多く蓄え、それらをデザインに反映できるか、これが成功の鍵であり、本研究の醍醐味であるといえます。
最近の研究から、こだわりの結果をいくつか以下に紹介します。
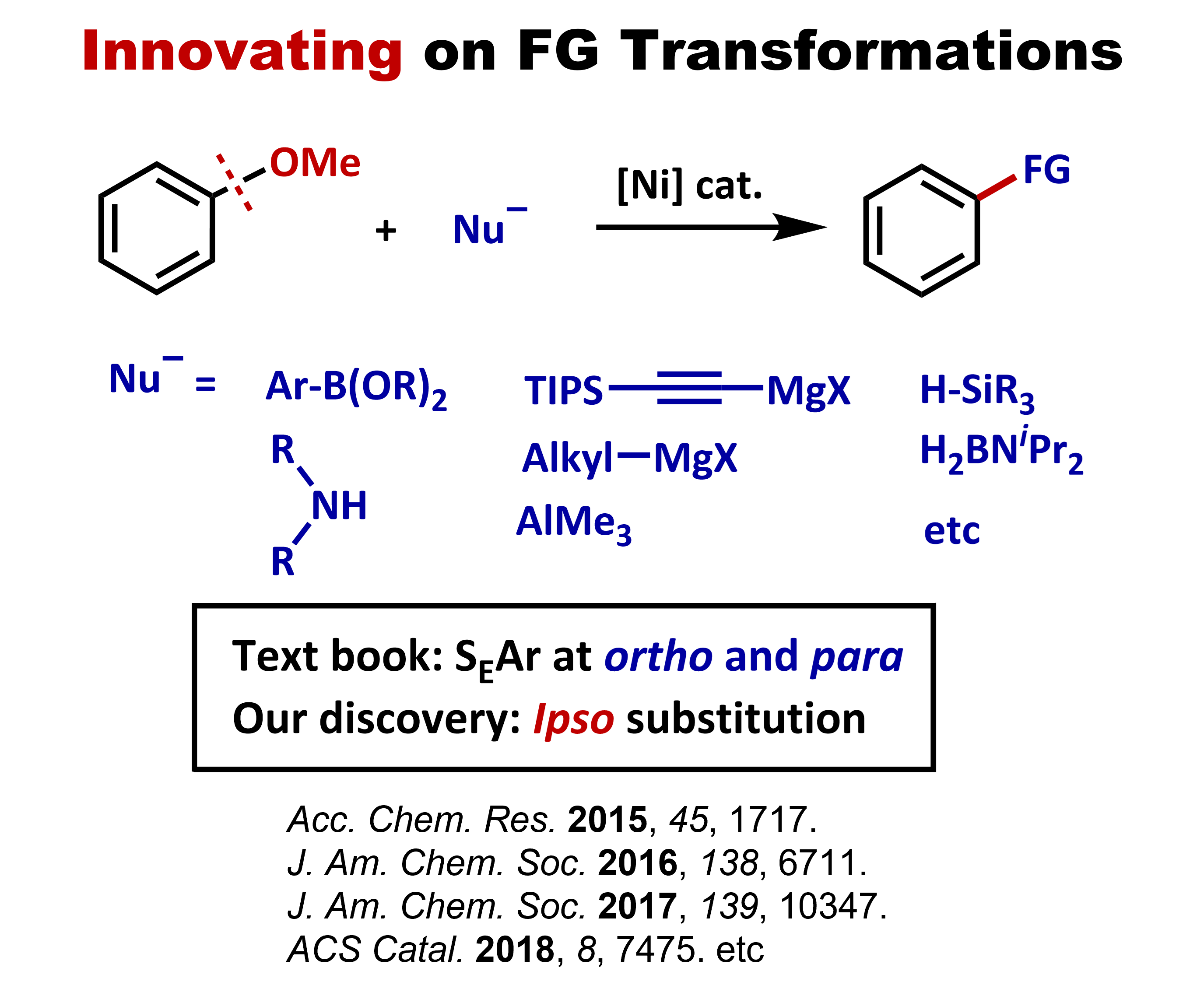
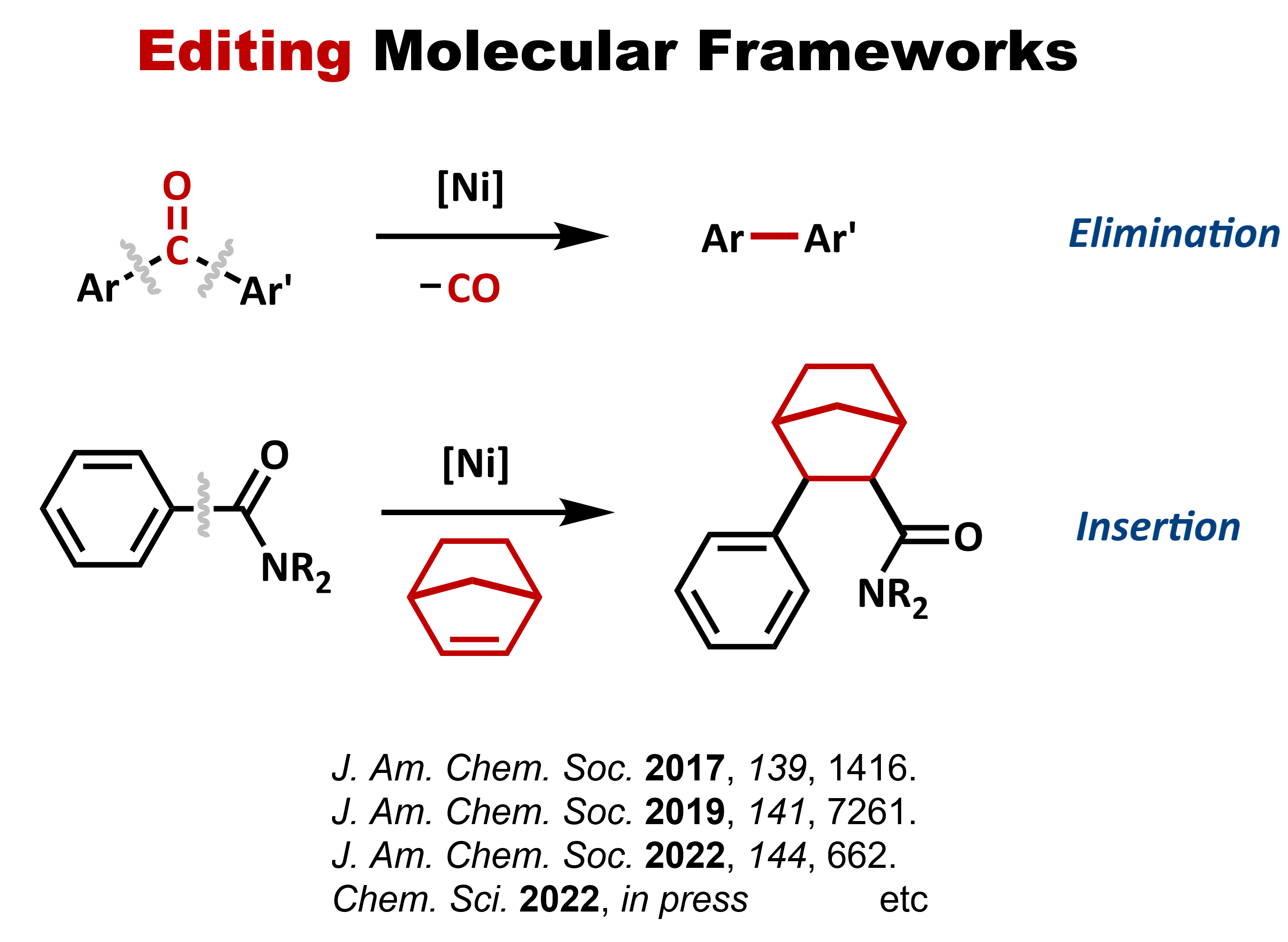
官能基は、分子に特有の性質を付与するとともに、有機合成において結合形成の足掛かりとなるなど欠かせない役割を果たします。したがって、有機化学の教科書では、官能基の導入や相互変換の手法に多くのページ数が割かれています。しかし、全ての官能基が相互に変換可能であるわけではありませんし、目的の官能基を導入するために、回り道をしなければ達成できないような場合もあります。われわれは、教科書的には直接変換することが困難とされている官能基を触媒的に変換する手法の開発に取り組んでいます。たとえば、芳香環上のメトキシ基は、芳香族求電子置換反応(SEAr)におけるオルト・パラ配向基として教科書に登場しますが、メトキシ基のイプソ位での置換反応は通常は起こりません。一方で、われわれはニッケル触媒を用いることで、アニソールと様々な求核剤との反応が進行し、メトキシ基が直接置換されるという反応を開発してきました。
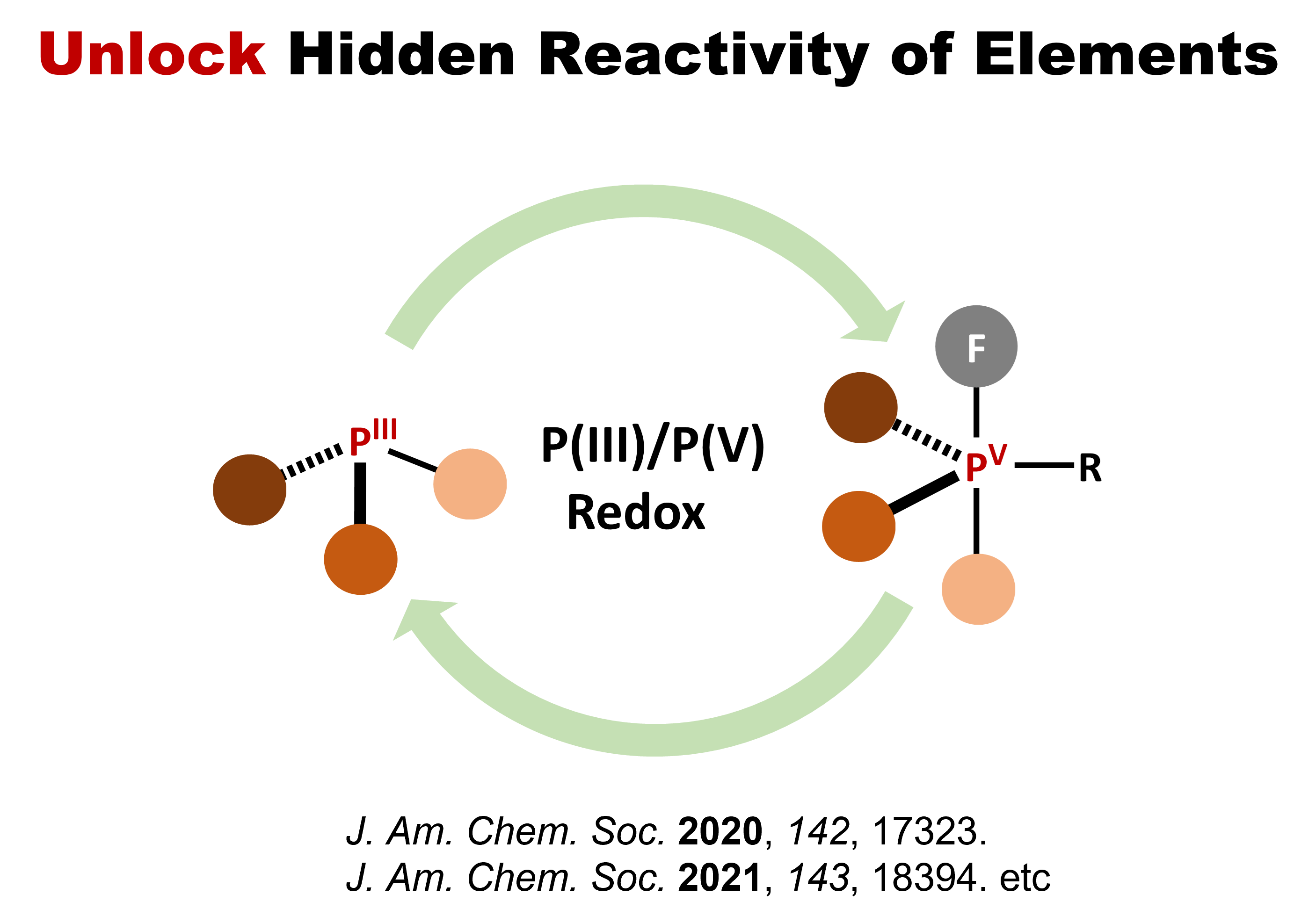
数多ある元素の個性を少しでも系統的に理解するために、化学者は周期表を片手に元素を分類・整理して、その反応性を明らかにしてきました。この分類・整理は学習者の理解を助ける反面、ともすれば元素の持つ性質すべてがその範疇に収まっているかのような錯覚を与える危険性を孕みます。この錯覚にとらわれず、元素の持つ隠れた個性に気づくことができれば、分類・整理の枠を超えた新しい反応性の発見につながることがあります。例えば、触媒を開発する際に、典型元素は酸・塩基の概念に基づく極性機構、遷移金属は酸化的付加・還元的脱離を経るレドックス機構、をそれぞれ想定して反応を設計することが一般的です。われわれは、リンという典型元素の触媒が価数変化をともなうレッドクス触媒機構を媒介することを明らかにし、貴金属でさえ為し得ない変換反応を達成しています。
Copyright(c)All right reserved. The Tobisu Group.





