研究プロジェクトPROJECT
科研費プロジェクト (基盤B) 研究代表者: 松崎 典弥
事業名:独立行政法人日本学術振興会 科学研究費補助金 基盤研究 (B)研究領域:複合領域、人間医工学、生体医工学・生体材料学
研究課題:がん-免疫細胞の相互作用を評価可能な灌流培養型腫瘍-間質3次元組織の創製
研究代表者:松崎典弥
期間:平成29年~平成31年度(3年間)
腫瘍組織は、主に腫瘍細胞とその周辺に存在する線維組織(間質)で構成されており、毛細血管や毛細リンパ管網、免疫細胞は間質組織に存在している。固形腫瘍では、この間質の割合が多く、大量の線維組織を含む場合が多い。従って、膵臓がんの場合、血中に投与された抗がん剤やドラッグデリバリーシステム(DDS)ナノ粒子は、豊富に存在する線維芽細胞やコラーゲンなどの細胞外マトリックス(ECM)線維によってその行く手を阻まれ、腫瘍細胞にたどり着ける分子は極めて少ない。また、がん関連線維芽細胞(CAF)は、細胞増殖因子や血管新生因子を産生することで、腫瘍細胞の増殖や浸潤を促進することが知られている(R. Kalluri et al., Nat. Rev. Cancer 6, 392 (2006))。最近、腫瘍細胞が、間質に存在するTリンパ球とPD-1レセプターを介して相互作用することで免疫逃避機構を発現することや(D. M. Pardoll, Nat. Rev. Cancer 12, 252 (2012))、間質細胞と腫瘍細胞の相互作用によって、侵襲性の高い大腸がんのサブタイプが発生すること(C. Isella et al., Nat. Genet. 47, 312 (2015))、などが報告されている。
このように、間質は、腫瘍細胞の運命を司る存在として、癌治療における新たなターゲットとして脚光を浴びつつある。例えば、間質の毛細血管の抑制を目的とした抗血管内皮細胞増殖因子(VEGF)抗体薬(ベバシズマブ)、腫瘍細胞とTリンパ球の相互作用を阻害する抗PD-1抗体(ニボルマブ)など、既に承認されている薬剤もある。これらの分子標的薬(特にニボルマブ)は、従来の抗がん剤では治療効果がほとんど無かった肺がんや皮膚がんに対して、30~40 %の高い治療効果が得られると報告されている(S. L. Topalian et al., New Engl. J. Med. 366, 2443 (2012))。ところが、副作用が課題であり、60~70%の患者には治療効果が無い。これは、患者間での腫瘍細胞の性質の違いやTリンパ球との相互作用の違いだけでなく、間質の構造や形態、細胞種、細胞外マトリックスなどの違いが原因であると言われている。そこで、副作用を軽減し、より高い治療効果を示す薬剤を開発するためには、腫瘍細胞とTリンパ球、および薬剤の相互作用を詳細に評価可能な実験系の確立が重要である。
一般的な実験系として、免疫不全マウスにヒト腫瘍細胞を移植した動物モデルが用いられているが、がん細胞の種類や動物種、移植臓器により腫瘍の性質が大きく異なるため、均質な腫瘍を作ることが難しく、再現性を低い。また、ヒトと動物の種差の課題もある。そこで、ヒトがん細胞や免疫細胞を用い、培地や血液を灌流可能な血管/リンパ管構造を有する腫瘍-間質3次元組織体を構築できれば、がん細胞-Tリンパ球-薬剤の相互作用を生体外で詳細に評価できると期待される。
「研究代表者の松崎」は、これまで、細胞表面にECM成分のナノ薄膜を形成すると(人工ナノECM)、このナノ薄膜が細胞膜インテグリン分子と相互作用し、3次元組織を形成可能な「細胞積層法」と「細胞集積法」を報告してきた(Angew. Chem. Int. Ed. 2007とAdv. Mater. 2011)。本手法により、1日に20層(100 µm)以上の3次元組織体の構築を可能とした。また、ヒト臍帯静脈血管内皮細胞(HUVEC)や正常ヒト皮膚微小リンパ管内皮細胞(NHDMEC)を正常ヒト皮膚線維芽細胞(NHDF)や間葉系幹細胞(MSC)とサンドイッチ培養することで、毛細血管・リンパ管網構造を有する3次元組織体の構築を見出した。さらに、本毛細血管・リンパ管組織の表面で膵がんおよび大腸がん細胞を培養することで、がん細胞の性質に応じた血管やリンパ管への浸潤と移動挙動の再現に成功した(図1、論文投稿中)。これは、研究分担者の西原・狩野との共同研究の成果である。
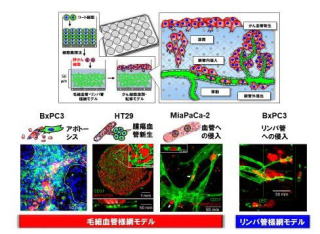
図1. がん細胞浸潤・転移実験のイメージ(上)と、腫瘍細胞の性質に応じた毛細血管・リンパ管様網への影響の違い(下)。MiaPaCa-2は血管へ浸潤し、BxPC3はリンパ管へ浸潤する。
「研究分担者の西原」は、患者由来の腫瘍細胞と間質細胞の初代培養技術を確立してきた。また、病理学的解析により、腫瘍の種類と血管、間質細胞、免疫細胞に着目して分類し、間質の構造と性状が化学療法の効果や予後と密接に関係する事実を世界で初めて報告した(Adv. Drug Deliv. Rev. 2014)。がん間質の病理学的解析の豊富な知識と経験を有しているため、本研究の腫瘍病理評価に必要不可欠である。
「研究分担者の狩野」は、難治固形腫瘍である膵癌に対するナノDDS治療の有効性を世界で初めて示しており(Proc.Natl. Acad. Sci. USA 2007)、固形腫瘍に関する深い知識と最先端治療の卓越した技術を有する。本研究の潅流型腫瘍血管の機能評価に必要不可欠である。
「研究分担者の井上」は、患者の腫瘍組織から細胞-細胞間接着を維持したまま細胞塊として調製・培養するcancertissue-originated spheroid(CTOS)法を世界で初めて報告した(Proc. Natl. Acad. Sci. USA2011)。このCTOSは、マウスに移植すると患者腫瘍と同様の組織像を維持し、がん細胞単体よりも生体の腫瘍に近い3次元構造と機能を有している。本研究は、生体のがん-免疫相互作用を評価可能な3次元組織の構築を目的としているため、本研究に最適である。
本研究の目的は、患者の腫瘍組織由来のCTOSを用いた潅流可能な血管/リンパ管を有する腫瘍-間質3次元組織の構築である。この目標達成のため、i) CTOSを用いた腫瘍-間質3次元組織体の構築、ii)潅流可能な血管/リンパ管を有する3次元組織体の構築、iii) 再構築腫瘍-間質組織体を用いたがん-免疫細胞の相互作用解析と薬剤感受性試験を行う。
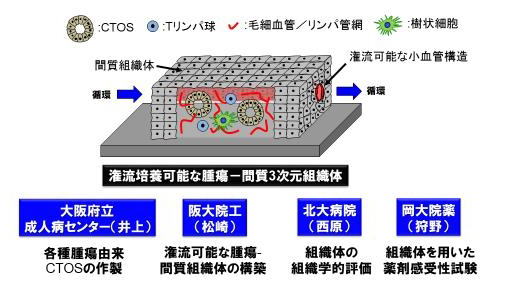
図2.本研究内容
研究プロジェクト一覧へ