【最近の主な研究内容】
将来の産業を支える高機能の材料や優れた医農薬品などを開発する際には、必要とされる物質を迅速かつ安価に提供することが鍵となる。その中心的役割を担う有機化学では、環境・資源・エネルギー問題の観点から、効率の良い反応系の創出が求められている。これは、いわゆるグリーンケミストリーへの転換にも通じる。この様な背景のもと、従来法に比して格段に優れた高効率・高選択的な新しい物質変換手法を開発することにより、「自然との調和」と「新技術の創出」を両立させる新触媒系・新元素機能発現系の開発を目指し、現在次に示すような研究を手がけている。
| 新型アニオン遷移金属錯体を用いる反応
|
|
オレフィンやジエンなどのπ炭素配位子を有する遷移金属錯体に有機金属試薬を作用させることにより生成するアート型錯体は、負電荷を有する電子密度の高い錯体である。もとの中性錯体と比べると、アート型錯体の分子軌道エネルギー準位は上昇し、その一般的な性質として、様々な分子に高い電子供与能を示し得ることが期待される。我々は、このアート型錯体の特性を活用することにより、
(?) アート型錯体の中心金属の高い求核性を利用するクロスカップリング反応の開発、
(?) 配位したオレフィンの求核的活性化を鍵とする触媒反応の開発、
(?) アート型錯体を1電子移動剤として利用するラジカル反応系の開発、
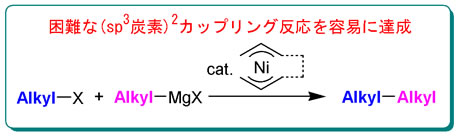
を目的に研究を行ってきた。その中で既に、グリニャール試薬とハロゲン化アルキルとの反応に於いて、ニッケルあるいはパラジウム触媒と1,3−ジエン類とを組み合わせて用いることにより、他法では達成することが困難な、(sp3)炭素−(sp3)炭素結合反応(クロスカップリング反応)が進行することを見出している。系中に発生すると考えられるビスπアリル金属が活性種であると提案してきたが、今まで確認するには至らなかった。そこで、既に構造が決定されている、ビスπアリルニッケル錯体を合成し、その反応性や触媒活性について詳細に検討した。その結果、実際にこの錯体がクロスカップリング反応の活性種であり、我々の考える反応経路が妥当であることを明らかにした。
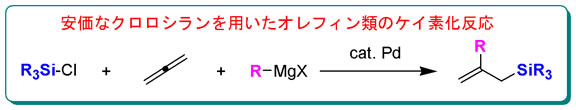
またパラジウム触媒存在下、アレン誘導体にケイ素および炭素官能基を一挙に位置選択的に導入するユニークな反応を開発した。この研究により、他法では達成困難な物質変換が容易に行え、またケイ素官能基導入試剤として、安価で入手容易なクロロシランの使用が可能となった。
|
| 極性反転型不安定活性種の生成と利用
|
|
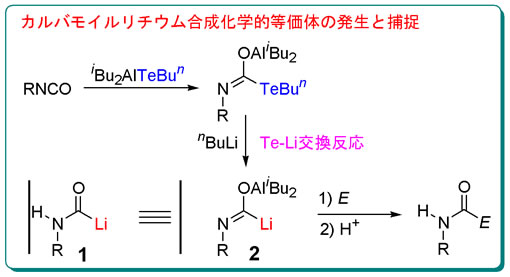
有機化学は、炭素、水素、酸素、および窒素を中心元素として含む化合物が主な研究対象である。しかし、その合成反応には、ヘテロ元素と呼ばれる様々な種類の元素が利用され、その特徴を活用する高効率な物質変換反応が開発されている。我々は、周期表第16族の元素であるテルルを利用する有機合成反応の開発に取り組んでいる。最近、イソシアナート誘導体と有機テルロアルミニウム試薬を用いることにより、従来法では発生させることが困難な極性反転型活性種2の発生と捕捉に成功すると共に、これが窒素原子上に水素または芳香族基を有するカルバモイルリチウム1の合成化学的等価体として利用可能であることを示した。
|
| アルキン類の触媒的カーボチオレーション
|
|
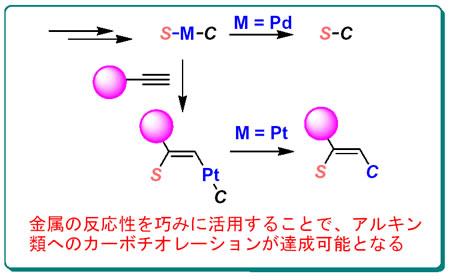
化学量論量の錯体を用いて、その反応性に関する詳細な研究を行った。その中で、2価錯体S−Pd−Cからは、S-C結合が容易に生成されるのに対して、S−Pt−CからのS−C結合の生成は熱力学的に不利な過程であり、S−Pt−Cフラグメントを有する錯体は安定な中間体として利用可能であることを見出した。この知見を触媒反応に活用することにより、白金触媒存在下、末端アルキン類の位置および立体選択的なカーボチオレーションが進行することを見出した。この反応では、炭素−硫黄結合と炭素−炭素結合を1つの反応で一挙に構築することが可能であり、反応基質の適用範囲も高い。
|
| ヘテロ環合成の新手法の開発
|
|
遷移金属触媒を用いて炭素―へテロ元素結合を切断し、これらのユニットをアルキンなどの不飽和炭化水素に付加させる反応は、(1)新しい炭素−炭素結合と炭素−ヘテロ結合を1段階で生成させること、(2)位置および立体選択的にアルケンが生成すること、(3)100%アトムエコノミーな反応であること、などの特徴を有する合成化学的に優れた手法の一つである。本研究では、これを分子内反応に応用することにより、エキソメチレン部位を有する様々な環状ヘテロ原子化合物の立体選択的合成が可能となることを明らかにした。例えば、0価パラジウム触媒による炭素―セレン結合の切断と、それに続くアルキンの分子内挿入反応を利用することにより、セレノカーバメートから薬理学的に重要な骨格であるα―アルキリデン−β−ラクタム骨格の立体選択的な高効率構築法を開発した。また、生成物のセレン官能基は有機銅試薬により炭素骨格に変換できるほか、本反応では5〜8員環のα―アルキリデンラクタムや、α―メチレンシクロブタノン環の合成も可能であり、本法はエキソメチレン部位を有する様々な環状化合物の合成法として有用であることを示した。
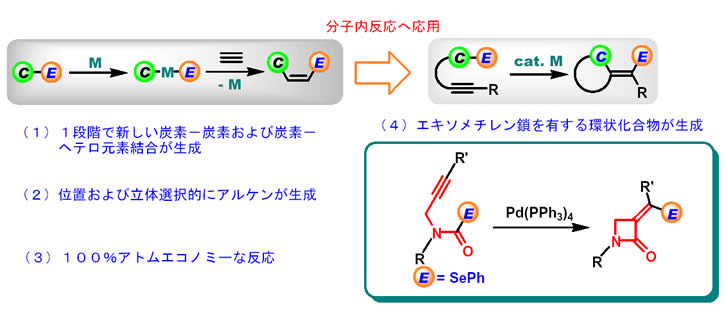
|
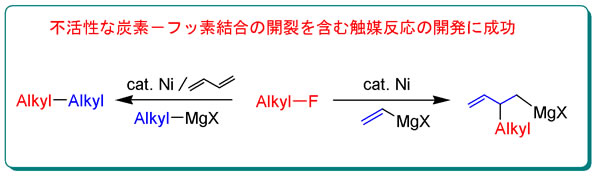
| 炭素−フッ素結合の開裂を含む有機合成反応の開発
|
|
我々は、有機化合物中で最も不活性な結合の一つと考えられている炭素−フッ素結合を、選択的かつ高効率に切断する反応の開発を目的とし研究を行っている。有機フッ素化物の利用法としては、従来その化学的安定性を活用する用途は多いものの、有機合成反応の基質として積極的に利用されることはなかった。最近我々は、(?)ハードなルイス酸性を有するMgカチオンによりフッ素の脱離能を高め、(?)ソフトな求核剤としてアート型遷移金属錯体を活用するというユニークな複合金属効果を活用することにより、フッ化アルキルの炭素−フッ素結合(C−F)を炭素−遷移金属結合(C−M)に変換する事に成功し、本過程を鍵とする触媒的炭素−炭素結合形成反応を見出している。
|
| 化学的手法による単一分子デバイスの作製 |
|
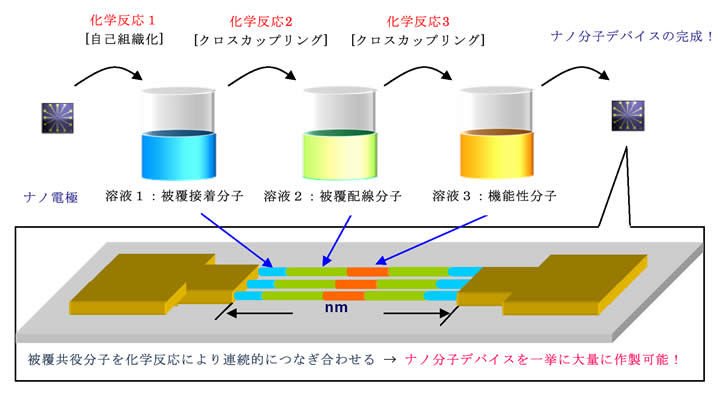
現在、広く用いられているシリコン半導体を基本とした情報処理デバイスは高集積化による性能向上を続けているが、近く微細化の限界に達すると予想されている。この現況を踏まえて、近年、単一分子デバイスや量子ドット記憶材料などの機能性有機分子素子の開発を目指した研究が盛んに行われている。しかしながら、ナノスケールのIT(情報技術)デバイスを実用化するには、ナノメートルサイズのギャップを持つ電極の特定の位置に共役分子を配置し、集積化するプロセス技術の開発が不可欠である。この様な背景を踏まえ、我々は、化学的手法による有機単一分子デバイスの作製を目的とした研究を推進している。例えば、適当な位置に官能基を有する被覆共役分子素子を合成し、ナノ電極のギャップ間で連続的に化学反応を行わせることにより、電極間を化学的手法により単分子で結線する手法を確立し、ナノ分子デバイスの新しい作製法の開発に成功した。従来型の物理的な結線手法に比べ、化学反応を利用する本手法を用いると、一挙に数多くの共役分子による結線が可能である。また、ナノ電極間で共役分子ユニットを順に組み上げるビルドアップ方式であるため、配線分子内に様々な機能を有する官能基を導入することが可能である。よって、本手法は、ナノ分子デバイスの作製法としての広い利用が期待される。
|